Коррозия металлов
Коррозия металлов и сплавов происходит при воздействии на них внешней среды, т е. веществ, с которыми металлические изделия соприкасаются во время храпения или применения.
Внешняя среда, с которой соприкасаются металлические изделия, может состоять из веществ, находящихся в газо образном, жидком или твердом состоянии. Вооружение при хранении и эксплуатации соприкасается прежде всего с воздухом, состоящим из кислорода, азота и инертных газов Воздух содержит различные примеси, такие как озон, соли, углекислый газ, и самое главное пары, а иногда и мельчайшие капельки воды — туман. Вооружение соприкасается с различными жидкостями — водными растворами солей, дождевой и снеговой водой, конденсационной влагой (роса), нефтепродуктами (масла, керосин, уайт-спирит и т. п.) и многими другими. Наконец, на боеприпасы могут действовать соприкасающиеся с ними твердые взрывчатые вещества, различные соли, входящие в капсюльные сплавы, и т п.
Если внешняя среда вызывает коррозию, то она называется агрессивной коррозионной средой, или сокращенно агрессивной средой для предметов вооружения агрессив ной средой могут служить одновременно несколько различ пых веществ. Однако в данных конкретных условиях всегда следует находись главную причит коррозии главного коррозионного агрессора. Для материальной части артиллерии, стрелкового оружия и артиллерийских приборов во время хранения их на складе или в парке главным коррозионным агрессором является вода, находящаяся в воздухе, оседающая на металлические части в виде росы или инея, а также выпадающая в виде дождя или снега.
Для внутренних поверхностей полостей противооткатных устройств артиллерийских орудий главной коррозионной средой может быть жидкость, которой эти полости заполнены. Для стенок камор снарядов н мин, а также авиабомб главной коррозионной средой являются взрывчатые вещества, которыми они снаряжены.
Способность металла сопротивляться коррозионному воздействию среды называется коррозионной стойкостью. Металл, хорошо сопротивляющийся коррозии, называется коррозионно-стойким. Металл, который плохо сопротивляется коррозионному воздействию внешней среды, называется коррозионно-нестойким. Однако, называя металл коррозионно-нестойким или коррозионно-стойким, надо всегда указывать, в какой среде он стоек или нестоек. Один и тот же металл может быть стойким в одной среде и совершенно нестойким в другой. Так, например, углеродистая сталь стойка в щелочной жидкости стеол М и нестойка в морской воде; алюминий довольно стоек в концентрированной азотной кислоте и нестоек в растворе щелочи.
Коррозия может быть сплошной, если она распространена по всей поверхности изделия, или местной, если она развилась только на отдельных участках поверхности металла; в последнем случае ее часто называют точечной коррозией, особенно если в результате разрушения металла образуются небольшие углубления — точки, которые затем, увеличиваясь в размерах, превращаются в раковины. При длительном процессе в раковинах могут образоваться сквозные отверстия — в этом случае мы будем иметь дело со сквозной коррозией.
Особым видом коррозии является так называемая межкристаллитная коррозия, при которой коррозионное разрушение, иногда незаметное при внешнем осмотре изделия, идет вглубь по границам зерен-кристалликов, из которых состоит металл (сплав). Этот вид коррозии очень опасен, так как разрушение металла идет очень быстро и сцепление между кристалликами ослабляется; в результате прочный металл становится очень непрочным, а иногда даже рассыпается в порошок. Как мы увидим дальше, такой вид коррозии наблюдается при хранении латунных изделий.
В зависимости от среды, в которой протекает коррозия, различают атмосферную, морскую, почвенную и газовую коррозию.
Атмосферная коррозия наблюдается, когда вооружение хранится в открытых парках. Морская коррозия происходит при эксплуатации вооружения на кораблях и на морском побережье. Почвенная коррозия наблюдается при нахождении вооружения непосредственно на земле или в земле.
Газовая высокотемпературная коррозия наблюдается при нагревании металла. Например, газовая коррозия происходит при нагревании стали до красного каления в печах и горнах, она проявляется образованием окалины. Газовая коррозия наблюдается также в каналах стволов артиллерийских орудий, пулеметов и другого огнестрельного оружия при выстреле, когда нагретые до очень высокой температуры пороховые газы химически воздействуют на металл ствола. Коррозионное разрушение этого вида обычно сопровождается так называемой эрозией, т. е. механическим размыванием металла нагретыми газами, движущимися с очень большой скоростью, а также тепловым воздействием газов на металл. Газовая коррозия металла при высоких температурах не имеет прямого отношения к сбережению оружия при хранении и эксплуатации, поэтому подробнее мы ее рассматривать не будем.
В зависимости от характера протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Процессы химической коррозии подчиняются основным законам чисто химических реакций, при которых не удается отметить появления и протекания электрического тока (например, коррозия в сухих газах, в сухих нефтепродуктах).
Процессы электрохимической коррозии подчиняются электрохимическим законам и обычно сопровождаются возникновением и протеканием электрического тока (коррозия в водных растворах кислот, щелочей и солей). Электрический ток может возникать в процессе коррозионного разрушения металла или сплава. Это явление используется в технике: все гальванические элементы, дающие электрическую энергию для питания карманных фонарей и многих приборов, вырабатывают электрический ток за счет протекания в элементе коррозионных электрохимических процессов. В подавляющем большинстве применяемых в практике гальванических элементов электрическая энергия вырабатывается за счет коррозии цинка, из которого сделан отрицательный электрод (анод).
Но коррозионные электрохимические процессы могут происходить и при протекании электрического тока, приложенного извне. Это наблюдается при растворении анодов в гальванических ваннах, при коррозии трубопроводов и других подземных сооружений под действием блуждающих электрических токов, протекающих в земле при прохождении трамвая, электропоезда и т. п.
Во всяком электрохимическом коррозионном процессе участвуют «коррозионная пара», состоящая из двух электродов, и электролит. Электролитом называют раствор какой-либо кислоты, щелочи или соли в воде (иногда в органической жидкости), способный проводить электрический ток с помощью ионов, т. е. являющийся проводником второго рода. Электролит служит той средой, в которой протекает процесс электрохимической коррозии.
При коррозии артиллерийского вооружения и боеприпасов электрохимические процессы могут протекать с участием различных электролитов; но все эти электролиты в качестве растворителя содержат воду, все они являются водными растворами различных солей и газов. Наиболее распространенным электролитом является атмосферная вода, в которой содержатся различные соли, иногда кислоты, и обязательно — растворенные кислород и углекислый газ. В осадках, выпадающих в промышленных районах, содержатся, кроме того, серная и сернистая кислоты, сероводород, угольная пыль и другие примеси. Примерно такие же примеси, иногда в большем количестве, содержатся в воде, осаждающейся на металлических предметах в виде росы и инея. Снег также содержит коррозионно-активные вещества и при таянии образует подснежную воду, которая представляет собой активный электролит. Электролитом является морская и соленая озерная вода, а также речная, болотная и почвенная, в которой, кроме перечисленных примесей, растворены различные органические кислоты.
Чем больше в воде растворено коррозионно-активных солей, кислот и других примесей, тем активнее электролит и тем большую коррозию он может вызвать.
В дождевой и снеговой воде, а тем более в осадке, выпадающем из паров воды, находящихся в воздухе, т. е. в росе, солей мало, и можно подумать, что в таких разбавленных растворах коррозия должна развиваться очень медленно, что такие слабые электролиты не способны вызвать сильную коррозию. Однако это не совсем так.
При высыхании на металле дождевой воды или росы количество ооли в воде увеличивается — к концу процесса высыхания 'раствор становится насыщенным. В таких концентрированных растворах коррозионные процессы могут проходить с большой скоростью.
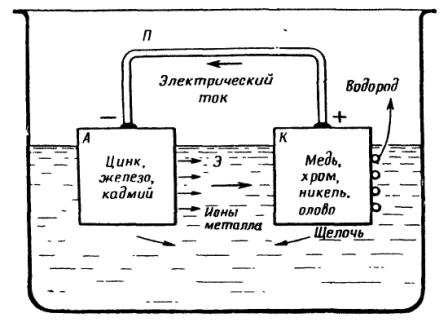
Рис. 1. Схема коррозионного гальванического элемента:
А — анод; К — катод; Э — электролит; П — проводник во внешней цепи
В электролитах все металлы приобретают определенный электродный потенциал, т. е. заряжаются отрицательно или положительно. Один и тот же металл в разных электролитах может иметь различный потенциал. Электродные потенциалы имеют очень большое значение в процессах электрохимической коррозии, так как направление коррозионного процесса зависит от того, какой из электродов коррозионного элемента имеет более электроотрицательный потенциал и какой — более электроположительный. Величина электродных пртенциалов, измеряемая в вольтах, до некоторой степени определяет скорость коррозии.
На рис. 1 приведена схема гальванического элемента, который состоит из отрицательного электрода — анода и положительного электрода — катода. Анодом всегда бывает металл, который в данном электролите обладает более электроотрицательным потенциалом, а катодом — металл, который обладает более электроположительным потенциалом. Коррозионный электрохимический процесс может протекать только в том случае, если оба электрода соприкасаются друг с другом или соединены между собой металлическим проводником и смочены электролитом, общим для обоих электродов.
Если железо соприкасается с медью и оба металла смочены общим электролитом, содержащим, например, хлористый натрий, то имеется коррозионный гальванический элемент, в котором анодом является железо, а катодом медь; разность потенциалов у такого элемента достигает величины около 0,55 вольта. Железо в этом элементе растворяется, образуя в растворе соли железа, а медь не разрушается— на ней образуется щелочь, и вблизи медного электрода электролит становится щелочным.
Здесь мы вплотную подошли к тому, как образуется ржавчина. Соли железа, образовавшиеся вблизи анода, распределяясь в электролите, встречаются со щелочью, образовавшейся на катоде; встретившись, они вступают в химическое взаимодействие, и образуется гидрат закиси железа Fe(OH)2 — не растворимое в воде студенистое вещество светло-зеленого цвета. Гидрат закиси железа окисляется присутствующим в электролите растворенным в нем кислородом и превращается в гидрат окиси железа Fe(OH)3 — вещество коричневого цвета, также плохо растворимое в воде. Гидраты окисей железа накапливаются в определенных местах, и после удаления электролита или высыхания смоченной им поверхности металла на нем остается коричневый налет или даже слой продуктов коррозии — ржавчина.
Ржавчина, таким образом, является продуктом вторичных химических реакций, иногда протекающих вблизи катодных или анодных поверхностей, а иногда очень далеко от них. Поэтому ржавчина может образоваться не только на прокорродировавшем металле, но и на деревянных деталях, которые соприкасаются со стальными, на бронзовых или латунных деталях и др.
Олово по отношению к железу, так же как и никель, является более электроположительным металлом. Поэтому царапина на луженом или никелированном железе представляет очаг электрохимической коррозии, Если на такое место попадет вода, то олово или никель становится катодом, а железо становится анодом и начинает быстро корродировать. Вот почему изделия из белой жести — бидоны, консервные банки и т. п. — при повреждении слоя олова быстро разрушаются.
Цинк имеет более отрицательный электродный потенциал, чем железо; если повреждено оцинкованное железо, то при попадании на поврежденное место воды железо становится катодом, а цинк анодом. При этом будет разрушаться цинк, а не железо. Вот почему оцинкованное железо может очень долго служить в самых тяжелых условиях и широко применяется, например, для крыш, не требующих окраски, для «цинковых» коробок, в которые укупориваются патроны, взрыватели и т. п., для различной посуды, ведер и других предметов. Оцинкование широко применяется для защиты различных деталей и элементов вооружения от коррозии, например деталей взрывателей, стальных гильз, панелей электротехнических приборов, крепежных деталей и т. п.
Защищая сталь от коррозии, сам цинк может быстро корродировать. На изделия, хранящиеся в. герметической укупорке или в сухом воздухе, достаточно нанести слой цинка толщиной 7—10 микрон, а на изделия, хранящиеся или используемые во влажном воздухе, особенно в приморских районах, наносят слой цинка толщиной 30—40 микрон.
Хромовое покрытие обладает положительным электродным потенциалом, а поэтому является катодным покрытием, не защищающим сталь от коррозии электрохимически. Чтобы надежно защитить стальные изделия от коррозии, хром наносят очень толстым слоем (60—100 микрон) либо, прежде чем произвести хромирование, наносят на поверхность изделия несколько слоев других металлов — меди, никеля, иногда латуни, добиваясь получения прочного и непористого покрытия. Повреждение слоя хрома опасно, так как сталь в поврежденном месте становится анодом и при наличии электролита, содержащего хлористые соли, начинает быстро корродировать. В этом можно убедиться, если понаблюдать за хромированными частями легковых автомобилей: в местах царапин, повреждений слоя хрома и в трещинах в сырую погоду быстро появляется ржавчина.
Коррозия хромированных поверхностей имеет большое значение для сбережения стволов стрелкового оружия, очем будет сказано в следующей главе.
Чтобы предупредить развитие сильной коррозии, все места, где сопрягаются или соприкасаются разнородные металлы, должны дополнительно защищаться от коррозии при помощи окраски, смазок и других средств, предохраняющих эти места от проникновения к ним электролита (воды, растворов солей, кислот и т. п.). За местами соприкосновения разнородных металлов и сплавов постоянно нужно наблюдать. Своевременная очистка этих мест от грязи, влаги и т. п. и смазывание их соответствующей смазкой помогут предупредить развитие электрохимической коррозии.
Коррозионные электрохимические «пары» возникают не только тогда, когда имеются разные металлы. Они могут возникнуть и при наличии одного металла, если различные участки его поверхности находятся в разных условиях (в разных средах). Это является следствием того, что разные участки металла имеют различные электродные потенциалы, если они омываются, например, растворами солей разной концентрации или одним и тем же раствором, но содержащим разное количество кислорода или другого окислителя.
Анодные участки на стали образуются всегда там, где она омывается электролитом, содержащим меньше кислорода, а катодные — там, куда кислорода подходит больше. Поэтому сталь корродирует в тех местах, куда доступ кислорода затруднен, а там, где электролит насыщен кислородом или постоянно получает его в избытке, образуются катодные участки и металл не корродирует или коррозия его протекает медленно.
Этот принцип «неравномерной аэрации» имеет очень большое значение для объяснения многих случаев коррозионного разрушения. Примером может служить коррозия стали при наличии на ее поверхности капли электролита, например капли соленой воды. На рис. 2 показана схема такой коррозии. Если через лупу наблюдать за развитием коррозии в капле электролита, то можно заметить, что с течением времени в центре капли образуется маленький бугорок белого цвета, который постепенно желтеет и становится коричневым. У краев капли под электролитом металл остается блестящим, не затронутым коррозией. Этот опыт показывает, что там, где кислорода меньше (в центре капли), железо растворяется, а по краям, куда кислорода приходит больше, коррозии нет.
По принципу «неравномерной аэрации» происходит развитие коррозии в трещинках, углублениях, в пазах, щелях
И т. п. Если изделие погружено б электролит, то разрушение обычно начинается там, куда доступ кислороду затруднен, а поверхности, к которым кислород, растворяющийся в электролите, подходит в большем количестве, корродируют значительно меньше или вообще не разрушаются.
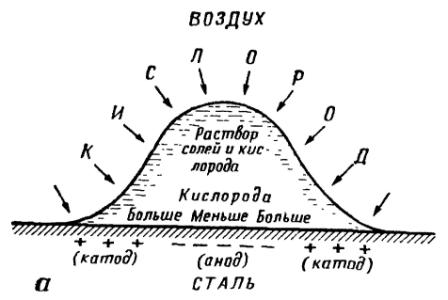
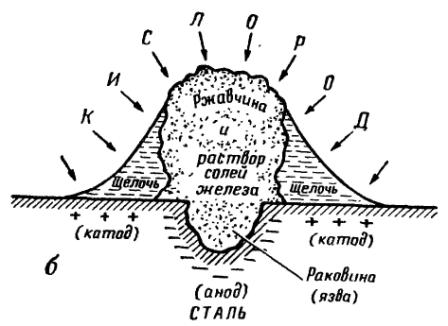
Рис. 2. Схема коррозии стали под кашей электролита:
а - начальная стадия коррозии; б — результат коррозии
Большое значение в борьбе с коррозией металлов имеет пассивность, которая является состоянием повышенной коррозионной устойчивости металла в условиях, когда он мог бы корродировать. Так, например, железо в разбавленной азотной кислоте быстро растворяется, а в крепкой — практически не корродирует; в концентрированной азотной кислоте оно пассивно. Железо пассивируется и в других кислотах, если к ним добавлены специально подобранные вещества — ингибиторы (замедлители) коррозии. Промышленность выпускает ингибитироваиную соляную кислоту для травления стали, в которой ржавчина и окалина растворяются, а металл почти не растворяется. Выпускается также ингибитор ЧМ для замедления растворения железа при травлении черных металлов в серной кислоте.
В воде и слабых растворах солей железо становится пассивным, если к ним добавлен хромовокислый калий, двухромовокислый калий, нитрит натрия и некоторые другие соли. Железо пассивно в щелочных растворах, что позволяет применять его в щелочных аккумуляторах. В пассивном состоянии могут находиться, кроме железа, хром, никель, алюминий, магний и другие металлы.
Пассивное состояние может сохраниться и после удаления пассивирующего раствора. Этим пользуются при ремонте стрелкового оружия, обрабатывая в растворах хромпика и хромовой кислоты те детали, которые не оксидируются (детали затворов, некоторые пружины и др.). Пассивированные стальные детали меньше подвергаются коррозии от прикосновения потных рук, от конденсации на деталях влаги. Однако пленки, получающиеся в растворах паосиваторов, обладают малой защитной способностью, так как они очень тонки, пористы и легко повреждаются при трении. Поэтому пассивирование является ненадежным способом защиты от коррозии. Только на алюминии образуются сравнительно толстые и механически прочные пленки окиси алюминия, придающей ему высокую коррозионную стойкость в водных растворах солей (не щелочных) и в атмосферных условиях. Алюминий пассивируется прямо на воздухе, но более толстые и прочные пленки получаются в растворах, содержащих сильные окислители.
Пассивирующее действие некоторых солей используется для защиты стальных деталей и узлов вооружения при хранении на складах. Хорошие результаты получены при применении для этой цели растворов нитрита натрия NaN02. Хорошо обезжиренные и очищенные от ржавчины детали покрывают (смачивают) раствором нитрита натрия, загущенного глицерином и крахмалом, и заворачивают в бумагу, пропитанную этим же раствором, а затем в парафинированную бумагу или подпергамент. Вследствие гигроскопичности раствор нитрита натрия и глицерина не высыхает и в течение всего времени хранения (более 5 лет) пассивирует сталь, отчего коррозия стали не развивается. Этим способом защищают от коррозии запасные стальные детали и агрегаты танков и тракторов.
Пассивное состояние могут вызвать также пары некоторых веществ, называемых летучими ингибиторами. Летучие ингибиторы (замедлители) коррозии получили большое применение как надежные средства предохранения стальных и чугунных изделий от коррозии при длительном хранении на складах, при перевозках и т. п.
В настоящее время разработан летучий ингибитор, дициклогексиламмонийнитрит, который изготовляется под маркой НДА; он способен защищать сталь от коррозии в течение 5—10 лет.
Летучие ингибиторы применяются в виде ингибиторной бумаги. Бумага либо пропитывается ингибитором, либо ингибитор (например, НДА) в смеси с раствором клея наносится на бумагу с одной ее стороны. >В ингибиторную бумагу заворачивают очищенные от ржавчины, грязи и смазок стальные изделия, а затем завернутые пакеты помещают в мешок из материала, не пропускающего пары ингибитора или задерживающего их. Для этого применяют парафинированную или битумированную бумагу, полиэтиленовую пленку, алюминиевую фольгу и т. п. Завернутые изделия хранят в ящиках или на стеллажах, предохраняя их от попадания воды.
При хранении и эксплуатации вооружения приходится считаться главным образам с атмосферной коррозией, при которой иа металлические детали действуют атмосферные осадки и воздух. Дождевая и снеговая вода, капельки тумана и росы содержат в растворенном виде различные соли (до 6 жг/л хлористого натрия, хлористый магний, сернистые соединения, сернокислые и сернистокислые соли, соли азотистой и азотной кислоты и др.), а также аммиак, кислород, углекислый газ и твердые частицы — пыль, органические остатки, микроорганизмы и др. Все эти примеси в атмосферной воде содержатся в очень малых количествах, причем в различных осадках и в разных местностях содержание примесей сильно меняется. Однако при высыхании капель дождевой воды или выпавшей за ночь росы, когда большая часть воды испарилась, концентрация солей и газов в оставшейся влаге очень сильно увеличивается и коррозия протекает уже в концентрированном растворе. Если испарение воды происходит быстро, то времени на коррозионный процесс остается мало, поэтому и разрушение металла бывает незначительным. При влажном воздухе высыхание протекает очень медленно. Медленное же высыхание пленки влаги на металле содействует развитию коррозионных процессов.
В сухом воздухе, т. е. в воздухе, лишенном воды или содержащем ее в количестве, меньшем определенного предела (находящегося в зависимости от температуры), коррозионные процессы на металле, например на обычной углеродистой стали, имеющей чистую поверхность, практически не развиваются в течение очень длительного времени.
При относительной влажности воздуха, меньшей 100%, протекает так называемая влажная коррозия. Большое значение в ускорении коррозии имеет наличие па металле различных загрязнений — солей, пота от рук и т. п. Соли — хлористый натрий (всегда присутствующий в воздухе, особенно вблизи морей и соленых озер), хлористый калий (содержащийся в пороховом нагаре), аммиачная селитра (входящая в состав многих взрывчатых веществ) и др. — способны поглощать влагу из воздуха, когда он еще ею далеко не насыщен. Поглощая влагу, соли растворяются в ней, образуя раствор, вызывающий коррозию металла. Поэтому для предотвращения ржавления оружия предъявляются строгие требования к своевременной и тщательной его чистке, а металлические детали защищаются различными покрытиями — оксидируются, фосфатируются и смазываются смазками.
При относительной влажности около 100%, когда воздух насыщается водяными парами и начинается выделение капель влаги на металле (выпадение росы), а также при попадании на металл капель от дождя, растаявшего снега и т. п. развивается мокрая атмосферная коррозия. Не защищенный покрытиями металл при мокрой коррозии, особенно при выпадении росы, очень быстро корродирует. Если несмазанное оружие внести с холода в теплое помещение, на металле, особенно на деталях затвора, уже через 20—30 минут образуется налет ржавчииы, после удаления которой можно рассмотреть мелкие раковинки.
При длительном воздействии на металл атмосферного воздуха большое значение имеет наличие в воздухе различных примесей — солей, кислотных газов, аммиака и т.п. По сравнению с коррозией обычной углеродистой стали в сухом незагрязненном «континентальном» воздухе коррозия той же стали на берегу моря, где в воздухе много солей, развивается в 30—40 раз быстрее, а в воздухе индустриальных городов—в 65—100 раз быстрее. Такая большая скорость коррозии в городском воздухе вызывается наличием в нем сернистых газов и сероводорода, образующихся при сжигании каменного угля, содержащего серу, а также от различных химических производств. Особенно сильная атмосферная коррозия наблюдается вблизи сернокислотных, аммиачных и содовых заводов.
Сильная атмосферная коррозия вооружения может наблюдаться при хранении его в сырых полуподвальных помещениях, в землянках, в ямах и других укрытиях, не приспособленных для этой цели. При хранении артиллерийского вооружения в открытых парках на охлажденном за ночь металле утром появляется большое количество осадков — росы. Роса, если она образовалась на незащищенном металле и быстро не высохла, может вызвать быстро протекающую коррозию. Массивные части вооружения нагреваются медленно, поэтому роса на них осаждается в течение нескольких часов. Особенно много росы образуется на поверхностях, расположенных ближе к земле, куда скатываются капли, образовавшиеся на верхних деталях оружия. Поэтому надо особенно часто осматривать вооружение в его нижних частях и удалять с них влагу сухой ветошью или бумагой КВ-22.